老化研究の記事
老化研究の記事 · 19日 10月 2018
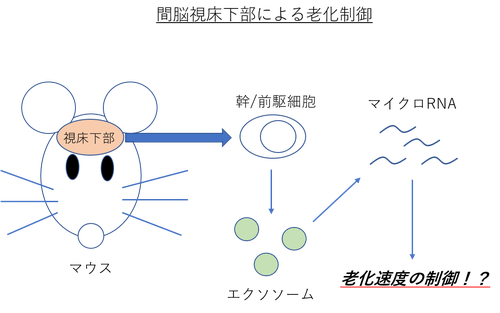
脳の視床下部が老化を制御しているといった内容の論文である。
これまでに、視床下部は老化の制御を助けると考えられていたが、そのメカニズムは不明であった。
今回、著者らは、幹細胞マーカーである “Sox2” と “Bmi1” を共に発現する視床下部幹/前駆細胞が除去されたマウスモデルを複数開発し、実験を行った。
いずれのマウスモデルにおいても、これらの視床下部細胞を大規模に失うことで、一貫して老化様の生理学的変化の促進、または寿命の短縮が見られたそうだ。
逆に、老化に関連した炎症性の視床下部微小環境においても生きられるように遺伝子改変した視床下部幹/前駆細胞を局所的に移植した中齢マウスでは、“老化の遅延” と “寿命の延長” が起きたという驚きの結果を彼らは得ている。
メカニズムとしては、まだ詳細には明らかになっていないが、視床下部幹/前駆細胞から分泌されるエクソソーマルマイクロRNA (miRNA) がどうやら部分的に老化速度の制御に関与しているようだ。
どの種類のエクソソーマルmiRNAが老化制御に大きく関わっているかなどは、これから明ら
老化研究の記事 · 18日 10月 2018
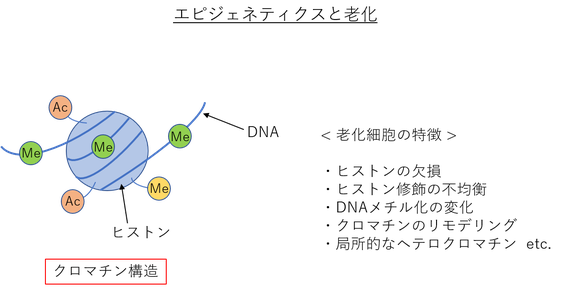
少し前から注目されている “エピジェネティクス”。
エピジェネティクスとは、DNAの塩基配列は変えずに、後から加わった修飾 (DNAメチル化やヒストン修飾) が遺伝子機能を調節する制御機構のことを一般的に指している。
・DNAメチル化
→ 真核生物でのメチル化はシトシンの5位にメチル基を付加する反応であり、シトシンとグアニンが隣接しているCpG部位でのメチル化は、トランスポゾンの転移抑制に強く関与していることが分かっている。
・ヒストン修飾
→ ヒストン修飾には、アセチル化やメチル化、ユビキチン化、リン酸化、SUMO化などが知られている。
ヒストンの修飾状態によって、ヒストンへのDNAの巻き付き具合が変化し、それに伴って遺伝子発現も変化する。
凝集度が高いクロマチンの形状を示す “ヘテロクロマチン” では転写レベルが低く、凝集度が低いクロマチンの形状を示す “ユークロマチン” では転写レベルが高い。
このエピジェネティック機構と寿命延長、老化の関係性についての総説を読んでみた。
老化研究の記事 · 17日 10月 2018
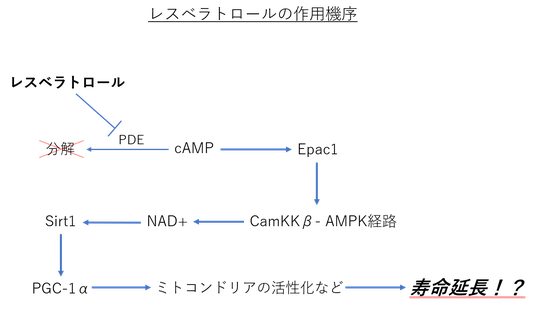
以前読んだ “レスベラトロールの作用機序” に関する論文である。
若返りに興味・関心がある方は、すでにご存知かもしれないが、“レスベラトロール” は赤ワインなどに含まれているポリフェノールであり、抗老化作用があるとされている。
では、一体どのようなメカニズムによって抗老化効果を示すのだろうか、気になったので調べてみた。
タイトルにもある通り、レスベラトロールはcAMPホスホジエステラーゼ (PDE) を
阻害することによって、cAMPの量を増加させる。
cAMPの量が増えると、cAMPのエフェクタータンパク質である "Epac1" が活性化する。
Epac1が活性化すると、細胞内カルシウムの量が増加し、"ホスホリパーゼC" と "リアノジン受容体カルシウム放出チャネル" を介してCamKKβ-AMPK経路が活性化される。
結果的に、NAD+の増加とSirt1の活性化が起こる。
以前の記事で取り上げたようにSirt (サーチュイン) は、“長寿遺伝子” として知られている。
老化研究の記事 · 12日 10月 2018
以前読んだ論文「スプライシング因子1は線虫の食餌制限およびTORC1経路による寿命を調節する」(2017年1月に発表された論文) を簡単にまとめようと思う。
この論文では、C. elegansというモデル生物を用いられている。
“C. elegans” という生物は、多細胞生物として最初に全ゲノム配列が解読された生物であり、体長約 1mm で透明な体をもつ線虫である。
性染色体による性決定は XO 型であり、XX の個体は雌雄同体になり、XO の個体は雄になる。
雌雄同体は幼虫期に 300 個弱の精子を作り、成虫期になると卵形成し、貯めておいた精子を使って自家受精を行うため、実験上、遺伝的な背景を均一にすることが出来るためモデル生物としてよく用いられている。
また、“スプライシング” についてだが、まずDNAからmRNA前駆体が転写され、このmRNA前駆体からイントロン部分の切り捨てが行われてエキソン部分が連結し、成熟mRNAが出来上がる。
この不要な部分の切り捨ての過程をスプライシングという。
老化研究の記事 · 10日 10月 2018
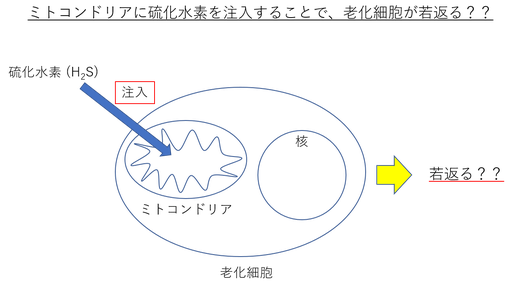
「イギリス エクセター大学の研究グループが、硫化水素を細胞内のミトコンドリアに注入することで、老化細胞を若返らせることに成功した。」という記事を発見した。
大変興味深い記事だったので、彼ら (イギリス エクセター大学の研究グループ) の元論文を読んでみた。
彼らは、Na-GYY4137などの硫化水素ドナーを用いて、老化したヒト内皮細胞のミトコンドリアに硫化水素を届けることによって、“スプライシング因子 (SRSF2, HNRNPD)” の発現を増加させた。
このスプライシング因子は、老化に伴って減少することが知られている。
実際に、ミトコンドリアへ硫化水素を届けることによって、老化マーカーである “p16” や “SA-β-gal” などの発現が低下していた。
しかし、老化細胞の特徴である “細胞周期の停止” や “テロメア長の短縮” などは回復させることが出来なかったようだ。
完全に、老化細胞を “若返らせた” とは言い切れないが、ヒトの細胞において部分的にでも老化をリバースさせたことは、かなりすごいことだと思う。
老化研究の記事 · 08日 10月 2018
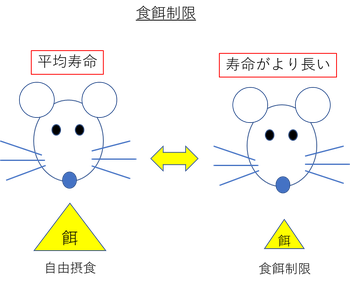
食餌制限による寿命延長効果は、酵母からマウスに至る様々な生物種において確認されている。
食餌制限には、二つの方法が知られており、一つは、継時的に総摂取カロリーを減らす "カロリー制限 (CR ; Calorie Restriction)"、もう一つは、自由摂食期間と摂食を行わない飢餓期間を繰り返す "断続的飢餓 (IF ; Intermittent Fasting)" である。
げっ歯類において、「CR」と「IF」の両方で、血中の "グルコース量" や "中性脂肪"、"インスリン量"、"成長ホルモン" が減少し、"インスリン感受性" や "遊離脂肪酸" が増加することが確認されている。
このように、身体的特徴は非常に似ている。
しかし、「IF」の方が「CR」よりも食餌制限による変化が起こるまでの期間が短いなど、変化が起こるまでの "期間" や変化の "度合い" には違いがみられる。
細胞は、置かれている環境によって "成長" を優先するか、"維持・管理" を優先するかを決めている。
栄養が十分である環境下においては、細胞は成長することを優先し、栄養が枯渇している環境下では、
老化研究の記事 · 08日 10月 2018
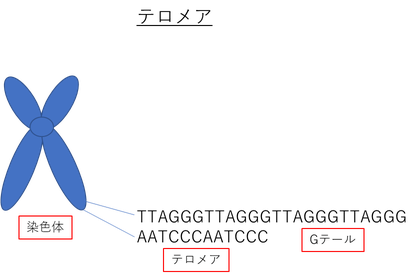
テロメアは、直鎖状二本鎖DNAを持つ真核生物に特徴的な構造であり、すべての染色体末端に存在している。
ヒトの場合、5'-TTAGGG-3' の繰り返し配列からなる二本鎖DNAであり、10~20キロ塩基対の平均テロメア長を有している。
このテロメアDNAは加齢に伴って短くなっていくことが知られている。
テロメアDNAの短縮が限界に近づくと "細胞老化" が誘導され、細胞増殖の停止が起こる。
老化を回避するためにはテロメアの維持が必須であり、このテロメアの維持機構は、"がん細胞" や "不死化細胞"、"幹細胞"、"iPS細胞" にも関与している。
がん細胞や不死化細胞は、テロメアを伸ばす働きを持つテロメア―ゼの活性化によって、老化を回避している。
しかし、約10%の細胞は、テロメラーゼを介さないテロメア維持機構を利用している。
また、テロメラーゼの活性化とテロメア長の維持は、細胞の初期化や、初期化された細胞の機能維持にも重要であることが知られており、樹立されたiPS細胞では、テロメアの長さがES細胞と同様の長さまでリセットされる。
この初期化に伴うテロメア―ゼの活性化は、
老化研究の記事 · 08日 10月 2018
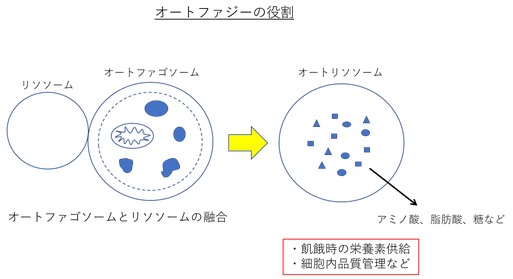
オートファジーは、細胞内の成分 (タンパク質、オルガネラ、感染細菌、グリコーゲンなど) を、アミノ酸、脂肪酸、糖などにまで分解し、"飢餓時の栄養素供給" や "細胞内品質管理" を行っている「細胞内分解経路」である。
近年、オートファジーが抗老化、寿命延長において重要な役割を担う可能性が示された。
これは、"オートファジーを欠損させると加齢関連疾患を発症したり、寿命が短縮すること" や、"加齢に伴って、オートファジーの活性が低下すること"、"寿命延長効果をもつ様々な遺伝学的方法および薬理学的方法は、オートファジーを誘導し、オートファジーを欠損させると寿命延長効果が消失すること" から、その可能性が支持されている。
具体的には、様々な生物種において寿命延長効果を示すカロリー制限も、オートファジーを誘導すると言われている。また、寿命延長効果をもたらすことが知られている "ラパマイシン (TOR阻害剤)"、"レスベラトロール (Sirt1活性化剤)"、"スペルミジン (ポリアミン)" といった代表的な薬剤もオートファジーを活性化させることで、寿命延長効果をもたらすことが分かっている。
老化研究の記事 · 30日 9月 2018
ヒトを含めた哺乳類のゲノム上には7種類のサーチュイン (SIRT1~7) が存在し、それぞれ細胞内の局在や役割が異なっている。
SIRT1は "核質" に局在し、SIRT2は主に "細胞質"、SIRT3~5は "ミトコンドリア"、SIRT6は "ヘテロクロマチン領域"、SIRT7は "核小体" に局在している。
また、SIRT1は核から細胞質へ移行し、SIRT2は細胞質から核へ移行することが知られている。
・SIRT1
→ カロリー制限によって、複数の臓器で発現が増加し、代謝に関わる多くの分子を制御することが知られている。
SIRT1による核内受容体PPARɤのコファクター1(PGC1α) の活性化は、糖新生、脂肪酸酸化、ミトコンドリアの活性化を促進する。
また、SIRT1をノックアウトしたマウスでは、カロリー制限による運動機能改善や寿命延長が見られなくなることから、SIRT1はカロリー制限による反応系において主要な因子であると考えられている。
SIRT1は、p53やFOXO、HIF1-1α / 2α などを介して "酸化ストレス" や "遺伝毒性ストレ
老化研究の記事 · 30日 9月 2018
研究者でなくとも、老化に興味がある人の中で "Sirtuin / サーチュイン" をご存知の方は多いのではないだろうか。
サーチュインは長寿遺伝子とも呼ばれ、老化研究において、かなり注目されている。
サーチュインの過剰発現による寿命延長効果は、出芽酵母や線虫、ショウジョウバエといった様々な生物種で確認されている。
カロリー制限による寿命延長効果に、このサーチュインが大きく関わっていると考えられている。
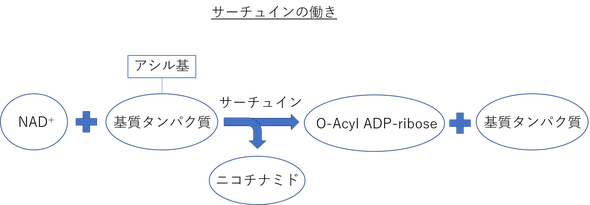
サーチュインは、NAD+依存的な基質タンパク質の脱アセチル (アシル) 化酵素活性を持っている。
このサーチュインが活性化することで、ヒストンの脱アセチル化が起こり、クロマチンのサイレンシングが誘導される。
現在では、サーチュインの基質としてヒストン以外のタンパク質も多く発見されている。
また、ヒトを含めた哺乳類のゲノム上には、7種類のサーチュイン (SIRT1~7) が存在している。
次回はこの7種類のサーチュインについて調べていこうと思う。
参考文献:実験医学 Vol. 31 No.20 (増刊) 2013, 45-47